ΤΟ STELARA® ΠΑΡΕΧΕΙ ΑΠΟΔΕΔΕΙΓΜΕΝΗ ΑΣΦΑΛΕΙΑ ΣΤΗ ΝΟΣΟ CROHN
ΕΜΠΙΣΤΟΣΥΝΗ ΧΑΡΗ ΣΕ ΜΙΑ ΚΛΗΡΟΝΟΜΙΑ 11 ΕΤΩΝ ΣΕ 5 ΑΝΟΣΟΜΕΣΟΛΑΒΟΥΜΕΝΕΣ ΦΛΕΓΜΟΝΩΔΕΙΣ ΝΟΣΟΥΣ2,3
Συνδυασμένα δεδομένα από 12 εγκριτικές μελέτες σε ασθενείς με ψωρίαση, ψωριασική αρθρίτιδα και νόσο του Crohn έδειξαν ότι τα ποσοστά διακοπής λόγω ανεπιθύμητων συμβάντων (ΑΕ) και η επίπτωση των ΑΕ, των σοβαρών ΑΕ και των λοιμώξεων συμφωνούσαν μεταξύ των ασθενών που έλαβαν STELARA® και των ασθενών που έλαβαν εικονικό φάρμακο έως το 1 έτος παρακολούθησης.
O STELARA ΔΙΑΤΗΡΕΙ ΜΑΚΡΟΧΡΟΝΙΑ ΕΝΑ ΠΡΟΦΙΛ ΑΣΦΑΛΕΙΑΣ ΠΑΡΟΜΟΙΟ ΜΕ ΑΥΤΟ ΤΟΥ ΕΙΚΟΝΙΚΟΥ ΦΑΡΜΑΚΟΥ
Χωρίς νέα ζητήματα ασφάλειας έως τα 5 έτη2,4
ΣΥΝΟΨΗ ΤΩΝ ΚΥΡΙΩΝ ΕΥΡΗΜΑΤΩΝ ΑΣΦΑΛΕΙΑΣ ΑΠΟ ΤΗΝ ΕΒΔΟΜΑΔΑ 0 ΕΩΣ ΤΗΝ ΕΒΔΟΜΑΔΑ 156 - ΟΛΟΙ ΟΙ ΑΣΘΕΝΕΙΣ ΠΟΥ ΕΙΣΗΛΘΑΝ ΣΤΗΝ LTE4
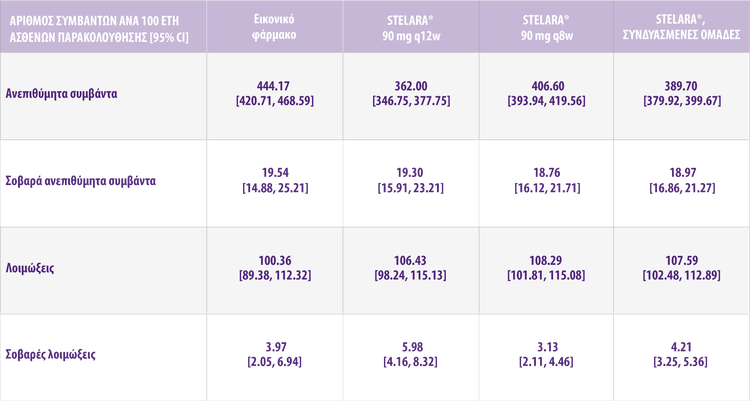
ΟΙ ΑΣΘΕΝΕΙΣ ΠΟΥ ΕΛΑΒΑΝ STELARA® ΕΙΧΑΝ ΠΑΡΟΜΟΙΑ ΠΟΣΟΣΤΑ ΛΟΙΜΩΞΕΩΝ ΜΕ ΑΥΤΟΥΣ ΠΟΥ ΕΛΑΒΑΝ ΕΙΚΟΝΙΚΟ ΦΑΡΜΑΚΟ3
ΥΨΗΛΟ ΠΟΣΟΣΤΟ ΜΟΝΟΘΕΡΑΠΕΙΑΣ STELARA ΣΤΑ 5 ΧΡΟΝΙΑ
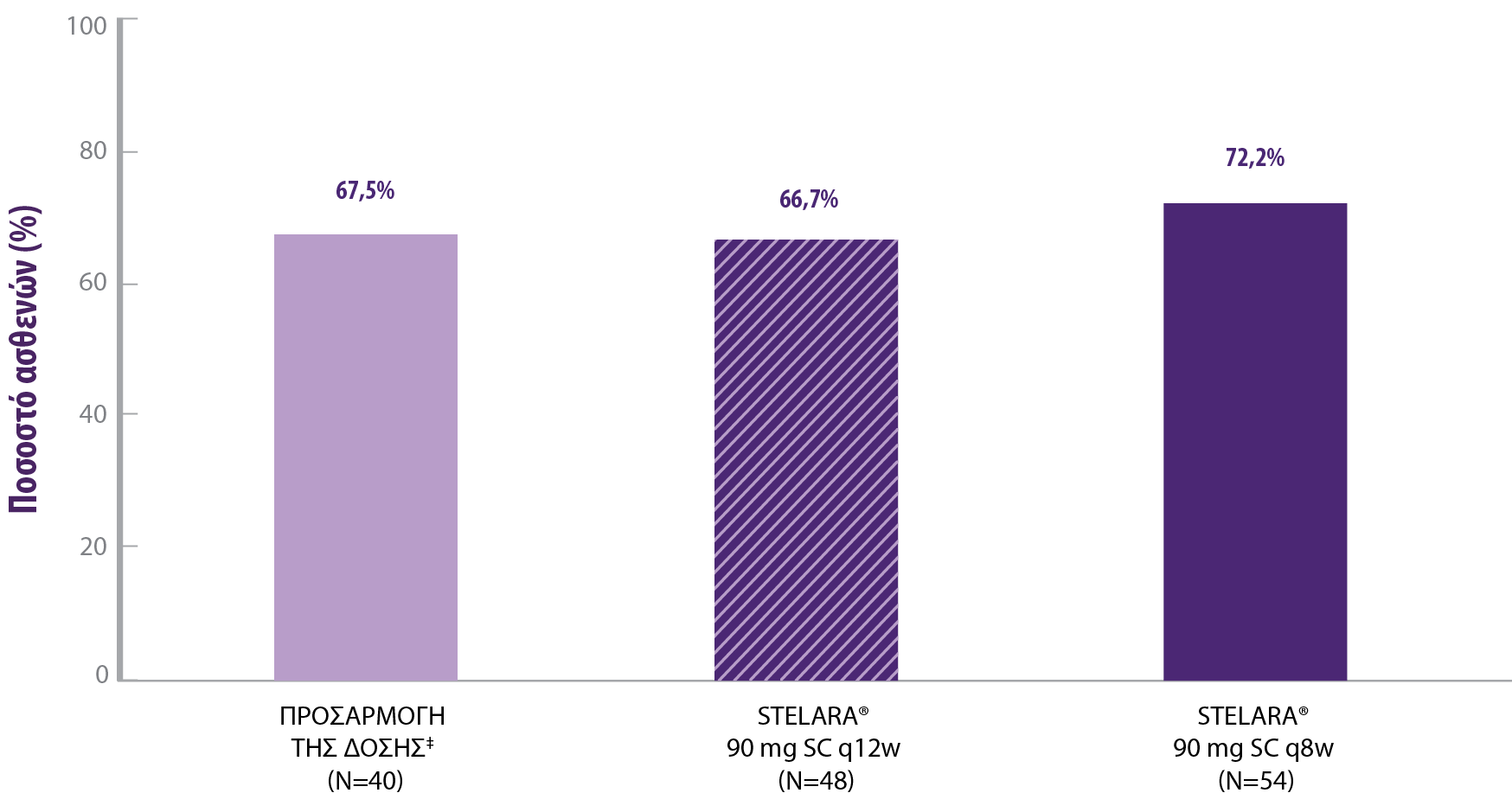
‡ Ασθενείς �που βρίσκονταν σε κλινική ανταπόκριση με τη θεραπεία επαγωγής με STELARA®, τυχαιοποιήθηκαν, κάλυψαν τα κριτήρια απώλειας της κλινικής ανταπόκρισης από την Εβδομάδα 8 έως την Εβδομάδα 32 και ξεκίνησαν θεραπεία με STELARA® 90 mg SC q8w (για τους ασθενείς που είχαν τυχαιοποιηθεί να λάβουν εικονικό φάρμακο SC ή STELARA® 90 mg SC q12w κατά την είσοδο στη μελέτη συντήρησης UNITI) ή συνέχισαν το STELARA® 90 mg SC q8w (για τους ασθενείς που είχαν τυχαιοποιηθεί να λάβουν STELARA® 90 mg SC q8w κατά την είσοδο στη μελέτη συντήρησης UNITI). Η προσαρμογή της δόσης δεν επιτρεπόταν στην LTE.
* Η μακροχρόνια ύφεση θεωρείται στόχος της ιδανικής θεραπείας στην κλινική αντιμετώπιση της ελκώδους κολίτιδας (ΕΚ).1
CD: νόσος του Crohn, LTE: μακροχρόνια επέκταση, SC: υποδόριος.
Βιβλιογραφία:
- Danese S et al. Dig Dis 2019;37:266-283.
- Stelara® 130 mg Περίληψη των Χαρακτηριστικών του Προϊόντος, 45 & 90 mg Περίληψη Χαρακτηριστικών του Προϊόντος
- Ghosh S et al. Drug Saf 2019;42(6):751-768.
- Sandborn WJ et al. Five-year Efficacy and Safety of Ustekinumab Treatment in Crohn’s Disease: the IM-UNITI trial, Clinical Gastroenterology and Hepatology (2021). doi: https://doi.org/10.1016/j.cgh.2021.02.025.
ΠΛΗΡΟΦΟΡΙΕΣ ΣΥΝΤΑΓΟΓΡΑΦΗΣΗΣ
ΑΝΑΦΟΡΑ ΑΝΕΠΙΘΥΜΗΤΩΝ ΕΝΕΡΓΕΙΩΝ