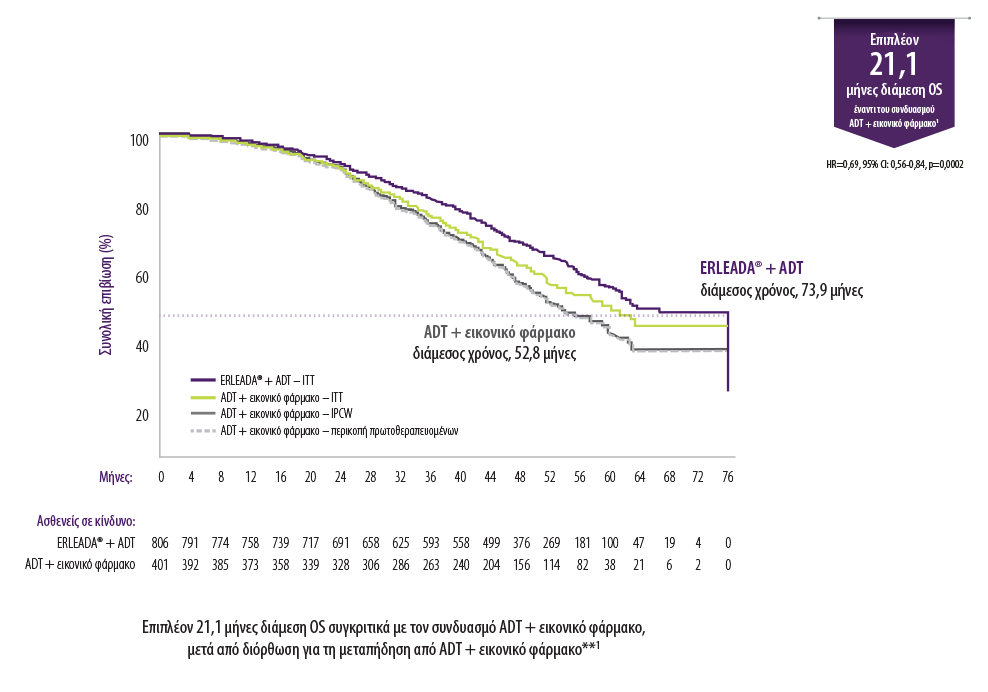
Ο συνδυασμός ERLEADA® + ADT προσφέρει διάμεση συνολική επιβίωση (OS) πάνω από 6 έτη από την έναρξη της θεραπείας*
To ERLEADA® ένας καινοτόμος αναστολέας της σηματοδότησης ανδρογόνων, προσφέρει στους ασθενείς με υψηλού κινδύνου nmCRPC σημαντικά κλινικά οφέλη και τους απαλλάσσει από τα συμπτώματα για μεγαλύτερο χρονικό διάστημα συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο
Κατά τη διάρκεια της τελικής ανάλυσης της μελέτης SPARTAN, ο συνδυασμός ERLEADA® + ADT προσέφερε επιπλέον 14 μήνες διάμεση OS συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο.*
Μετά τη διόρθωση για τη διασταυρούμενη μετάβαση (crossover), η θεραπεία ERLEADA® + ADT προσέφερε στους ασθενείς επιπλέον 21,2 μήνες διάμεση OS συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο.**
Με διάμεση περίοδο παρακολούθησης πάνω από 4 έτη, η θεραπεία ERLEADA® + ADT εξασφαλίζει στους ασθενείς σταθερή ασφάλεια και ανοχή.
*Η διάμεση OS ήταν 73,9 μήνες με τον συνδυασμό ERLEADA® + ADT συγκριτικά με 59,9 μήνες με τη θεραπεία ADT + εικονικό �φάρμακο. HR=0,78, 95% Cl=0,64-096, P=0,0161.
**Όταν τα δεδομένα της OS για τον συνδυασμό ERLEADA® + ADT διορθώθηκαν για τη διασταυρούμενη μετάβαση (crossover)19% των
ασθενών από το σκέλος ADT + εικονικό φάρμακο, το όφελος της διάμεσης επιβίωσης με τη θεραπεία ERLEADA® + ADT αυξήθηκε κατά 50%, σε 21,1 μήνες συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο.
Μηχανισμός δράσης
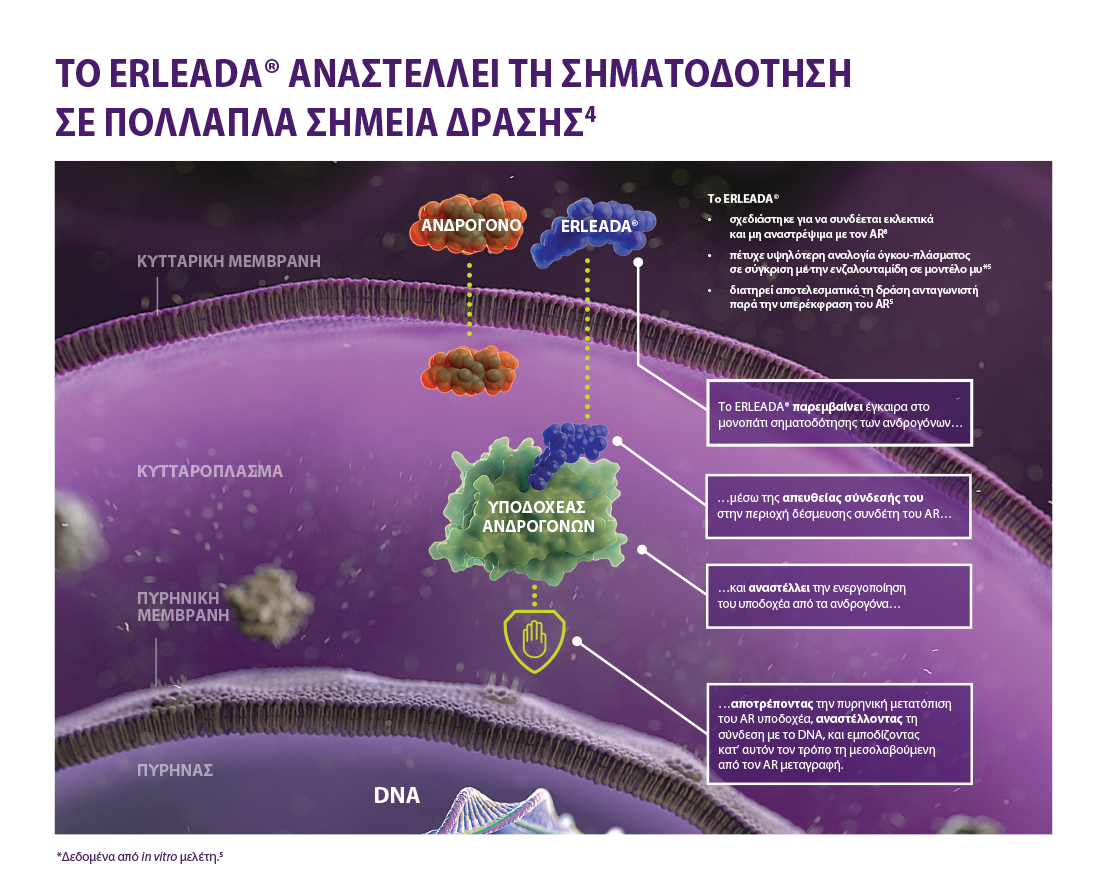
Το ERLEADA® έχει σχεδιαστεί ώστε να αναστέλλει σημαντικούς ρυθμιστές της εξέλιξης του καρκίνου του προστάτη

- Εκλεκτική δέσμευση
- Ευνοϊκή συγγένεια δέσμευσης
- Πλήρως ανταγωνιστικό
- Χωρίς σημαντική δράση αγωνιστή*
- Χαμηλές πιθανότητες επιληπτικών κρίσεων

- Συνδέεται απευθείας στην περιοχή δέσμευσης συνδέτη του AR
- Αποτρέπει την πυρηνική μετατόπιση του AR
- Αναστέλλει τη σύνδεση με το DNA
- Εμποδίζει τη μεσολαβούμενη από τον AR μεταγραφή
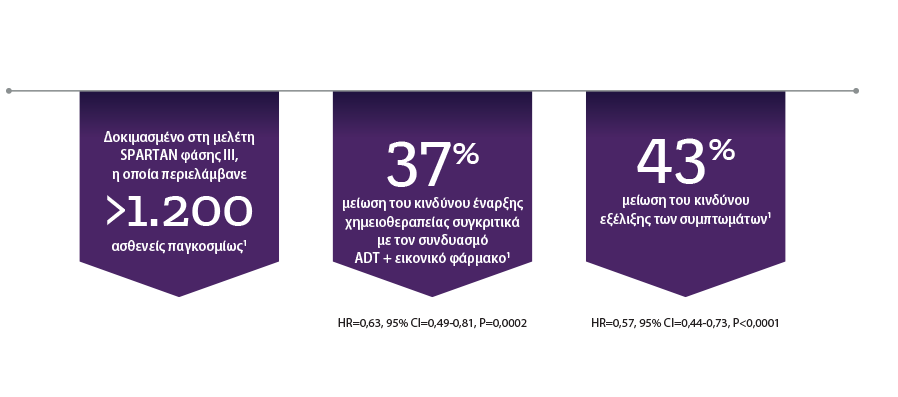
Ο συνδυασμός ERLEADA® + ADT προσφέρει στους ασθενείς με υψηλού κινδύνου nmCRPC σημαντικά κλινικά οφέλη συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο.
*Σε in vitro μελέτη, η μέγιστη θεραπευτική ανταπόκριση επιτεύχθηκε με τη χαμηλότερη δόση του ERLEADA® σε σύγκριση με άλλους αναστολείς του AR.

Αποτελεσματικότητα
Ο συνδυασμός ERLEADA® + ADT προσφέρει στους ασθενείς με υψηλού κινδύνου nmCRPC σημαντικά βελτιωμένη συνολική επιβίωση και άλλα κλινικά οφέλη συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο
Ο συνδυασμός ERLEADA® + ADT προσφέρει διάμεση OS πάνω από 6 έτη από την έναρξη της θεραπείας*
ΣΥΝΟΛΙΚΗ ΕΠΙΒΙΩΣΗ ΣΤΟΝ ΜΗ ΔΙΟΡΘΩΜΕΝΟ ΠΛΗΘΥΣΜΟ ΑΣΘΕΝΩΝ

ΣΥΝΟΛΙΚΗ ΕΠΙΒΙΩΣΗ ΔΙΟΡΘΩΜΕΝΗ ΓΙΑ ΤΗ ΔΙΑΣΤΑΥΡΟΎΜΕΝΗ ΜΕΤΆΒΑΣΗ (CROSSOVER) ΣΤΟ ΣΚΈΛΟΣ ERLEADA® + ADT ΑΠΟ ΤΟ ΣΚΕΛΟΣ ADT + ΕΙΚΟΝΙΚΟ ΦΑΡΜΑΚΟ
Η ΧΟΡΗΓΗΣΗ ERLEADA® + ADT ΣΕ ΠΡΩΙΜΟ ΣΤΑΔΙΟ ΠΡΟΣΦΕΡΕΙ ΣΤΟΥΣ ΑΣΘΕΝΕΙΣ ΤΗ ΔΥΝΑΤΟΤΗΤΑ ΝΑ ΖΗΣΟΥΝ ΠΕΡΙΣΣΟΤΕΡΟ ΣΕ ΣΥΓΚΡΙΣΗ ΜΕ ΤΟΝ ΣΥΝΔΥΑΣΜΟ ADT + ΕΙΚΟΝΙΚΟ ΦΑΡΜΑΚΟ
• Η έκβαση της συνολικής επιβίωσης υποστηρίχθηκε από μια στατιστικά σημαντική βελτίωση στον χρόνο εξέλιξης των συμπτωμάτων
ΧΡΟΝΟΣ ΕΩΣ ΤΗΝ ΕΞΕΛΙΞΗ ΤΩΝ ΣΥΜΠΤΩΜΑΤΩΝ
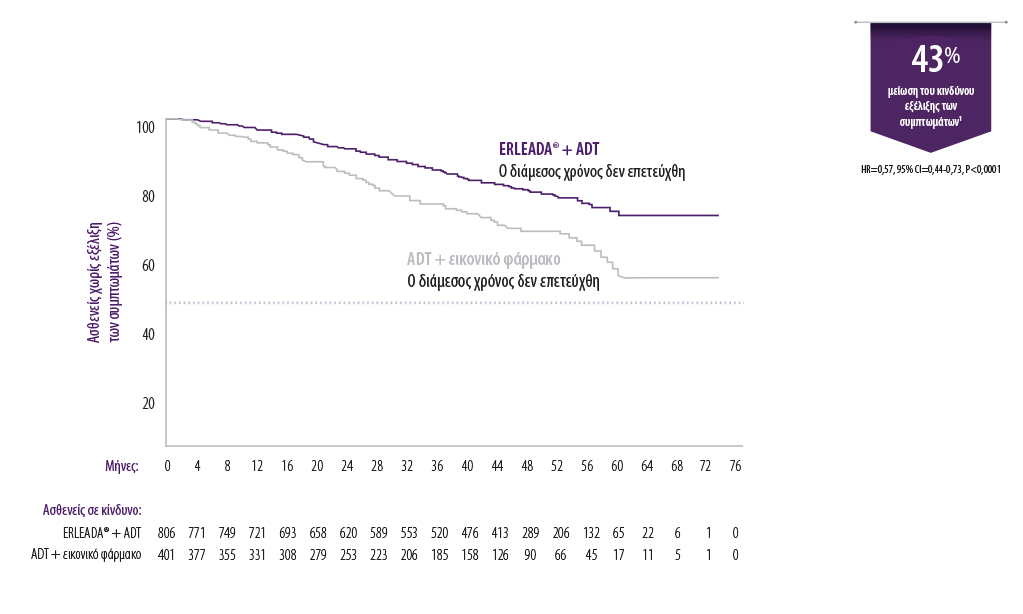
ΧΡΟΝΟΣ ΕΩΣ ΤΗ ΧΗΜΕΙΟΘΕΡΑΠΕΙΑ
Ο συνδυασμός ERLEADA® + ADT καθυστέρησε σημαντικά τον χρόνο έως τη χημειοθεραπεία. Αυτό σημαίνει ότι το ERLEADA® μπορεί να βοηθήσει στην ελαχιστοποίηση του χρόνου παραμονής στο νοσοκομείο για τους ασθενείς και τους φροντιστές τους.
ΑΝΤΑΠΟΚΡΙΣΗ ΤΟΥ PSA
Ο συνδυασμός ERLEADA® + ADT προσέφερε μείωση του PSA >50% στο 93% των ασθενών στο 1ο 3μηνο.
ΙΤΤ=πληθυσμός με πρόθεση θεραπείας, IPCW= τεχνική της στάθμισης με την αντίστροφη πιθανότητα λογοκρισίας, mCRPC=μεταστατικός, ανθεκτικός στον ευνουχισμό καρκίνος του προστάτη.
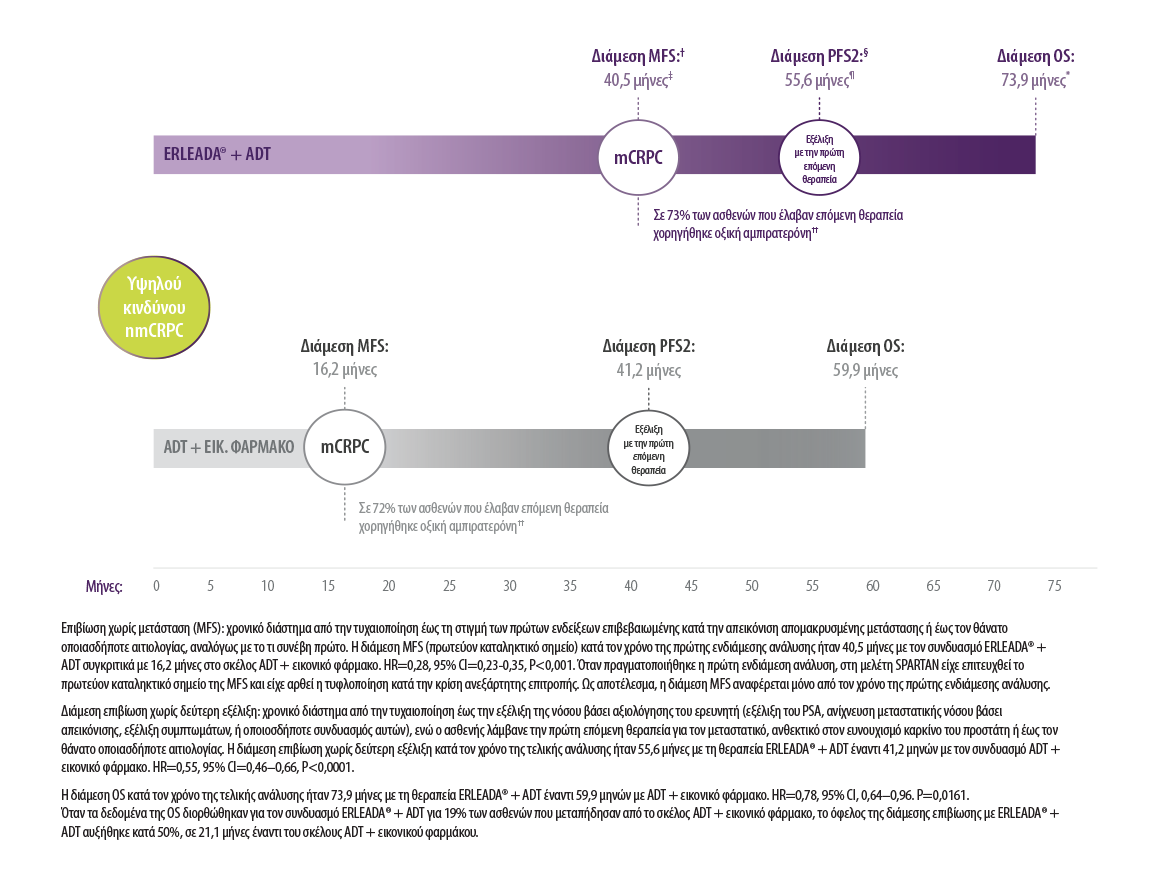
*Η διάμεση OS ήταν 73,9 μήνες με τον συνδυασμό ERLEADA® + ADT συγκριτικά με 59,9 μήνες με τη θεραπεία ADT + εικονικό φάρμακο. HR=0,78, 95% Cl=0,64-096, P=0,0161. **Όταν τα δεδομένα της OS για τον συνδυασμό ERLEADA® + ADT διορθώθηκαν για τη διασταυρούμενη μετάβαση (crossover) 19% των ασθενών από το σκέλος ADT + εικονικό φάρμακο, το όφελος της διάμεσης επιβίωσης με τη θεραπεία ERLEADA® + ADT αυξήθηκε κατά 50%, σε 21,1 μήνες συγκριτικά με τον συνδυασμό ADT + εικονικό φάρμακο. †Επιβίωση χωρίς μετάσταση (MFS): χρονικό διάστημα από την τυχαιοποίηση έως τη στιγμή των πρώτων ενδείξεων επιβεβαιωμένης κατά την απεικόνιση απομακρυσμένης μετάστασης ή έως τον θάνατο οποιασδήποτε αιτιολογίας, αναλόγως με το τι συνέβη πρώτο. ‡Η διάμεση MFS (πρωτεύον καταληκτικό σημείο) κατά τον χρόνο της πρώτης ενδιάμεσης ανάλυσης ήταν 40,5 μήνες με τον συνδυασμό ERLEADA® + ADT συγκριτικά με 16,2 μήνες στο σκέλος ADT + εικονικό φάρμακο. HR=0,28, 95% CI=0,23-0,35, P<0,001. Μία μεμονωμένη, τελική ανάλυση της MFS προγραμματίστηκε και διενεργήθηκε μετά από απομακρυσμένη μετάσταση ή θάνατο σε 378 ασθενείς. Επειδή το πρωτεύον καταληκτικό σημείο (MFS) επιτεύχθηκε κατά την πρώτη ενδιάμεση ανάλυση, άρθηκε η τυφλοποίηση της μελέτης κατόπιν σύστασης μιας ανεξάρτητης επιτροπής. §Διάμεση επιβίωση χωρίς δεύτερη εξέλιξη: χρονικό διάστημα από την τυχαιοποίηση έως την εξέλιξη της νόσου βάσει αξιολόγησης του ερευνητή (εξέλιξη του PSA, ανίχνευση μεταστατικής νόσου βάσει απεικόνισης, εξέλιξη συμπτωμάτων, ή οποιοσδήποτε συνδυασμός αυτών), ενώ ο ασθενής λάμβανε την πρώτη επόμενη θεραπεία για τον μεταστατικό, ανθεκτικό στον ευνουχισμό καρκίνο του προστάτη ή έως το θάνατο οποιασδήποτε αιτιολογίας. ¶Η διάμεση PFS2 κατά τον χρόνο της τελικής ανάλυσης ήταν 55,6 μήνες με τη θεραπεία ERLEADA® + ADT έναντι 41,2 μηνών με τον συνδυασμό ADT + εικονικό φάρμακο. HR=0,55, 95% CI=0,46–0,66, P<0,0001. ††Όλοι οι ασθενείς, οι οποίοι παρουσίασαν απομακρυσμένη μετάσταση, επιβεβαιωμένης μέσω τυφλοποιημένης ανεξάρτητης κεντρικής ανασκόπησης (BICR), ήταν κατάλληλοι να λάβουν επόμενη θεραπεία. §§Ο διάμεσος χρόνος δεν επετεύχθη για κανένα σκέλος της μελέτης. HR=0,63, 95% CI, 0,49–0,66. P=0,0001.
Ασφάλεια
Μετά από διάμεση παρακολούθηση πάνω από 4 έτη, δεν έχουν διαπιστωθεί νέα ζητήματα για την ασφάλεια για τον συνδυασμό ERLEADA® + ADT
ΣΥΝΟΨΗ ΑΝΕΠΙΘΥΜΗΤΩΝ ΕΝΕΡΓΕΙΩΝ

ΟΙ ΠΙΟ ΣΥΧΝΕΣ ΕΜΦΑΝΙΖΟΜΕΝΕΣ ΚΑΤΑ ΤΗ ΘΕΡΑΠΕΙΑ ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ†
Οι πιο συχνές εμφανιζόμενες κατά τη θεραπεία ανεπιθύμητες ενέργειες (οι οποίες παρατηρήθηκαν σε >15% των ασθενών του σκέλους ERLEADA® + ADT της μελέτης)

Τα ποσοστά εξανθήματος, πτώσεων και καταγμάτων ανά όρο κατηγορίας για το σκέλος ERLEADA® + ADT (ποσοστό συμβάντων/100 έτη ασθενών) δεν άλλαξε σημαντικά μετά την πρώτη και τη δεύτερη ενδιάμεση ανάλυση της μελέτης SPARTAN.
Αντιμετώπιση εξανθήματος
Στην πρώτη ενδιάμεση ανάλυση της μελέτης SPARTAN, το δερματικό εξάνθημα που αναφέρθηκε σε ασθενείς που έλαβαν ERLEADA® + ADT ήταν γενικά ήπιο και παροδικό, και μπόρεσε να αντιμετωπιστεί με τις συνήθεις θεραπείες.
Το σχετιζόμενο με το ERLEADA® δερματικό εξάνθημα περιγράφηκε συνήθως ως κηλιδώδες ή κηλιδοβλατιδώδες. Ο διάμεσος χρόνος έως την εμφάνιση εξανθήματος ήταν 82 ημέρες στους ασθε�νείς που έλαβαν θεραπεία με ERLEADA® + ADT. Το εξάνθημα απέδραμε σε 81% των ασθενών εντός διάμεσου χρόνου 60 ημερών από την εμφάνισή του.
*Διάρκεια θεραπείας με ERLEADA®·+ ADT μετά τη μεταπήδηση από το σκέλος ADT + εικονικό φάρμακο.
**Αναφέρονται όλες οι ΑΕ που οδήγησαν σε διακοπή. Ωστόσο, οι αναφερόμενες ΑΕ μπορεί να μην αποτελούν τον κύριο λόγο διακοπής. Οι ασθενείς μετρούνται μόνο μία φορά για οποιοδήποτε συγκεκριμένο συμβάν, ανεξάρτητα από τις φορές που παρουσίασαν το συμβάν.
†Οι ασθενείς μετρούνται μόνο μία φορά για οποιοδήποτε συγκεκριμένο συμβάν, ανεξάρτητα από τις φορές που παρουσίασαν το συμβάν. Χρησιμοποιείται το συμβάν που παρουσίασε ο ασθενής με τον χειρότερο βαθμό τοξικότητας.
Εάν για όλες τις ΑΕ που παρουσίασε ένα ασθενής έλειπαν οι βαθμοί τοξικότητας, ο ασθενής μετριέται μόνο στη στήλη «Όλοι οι βαθμοί».
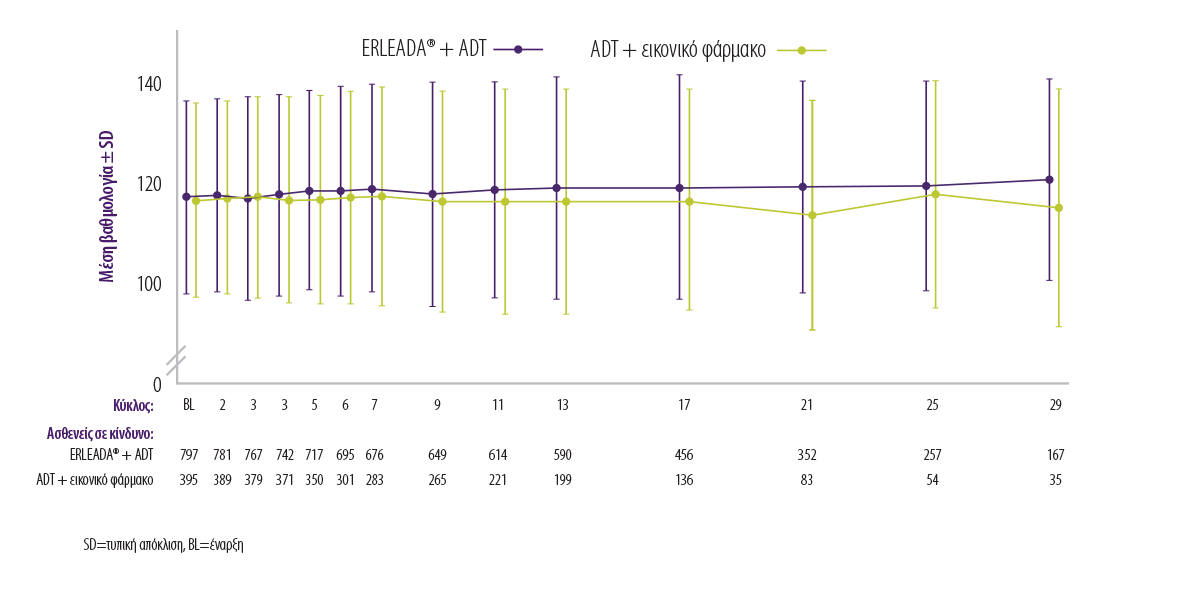
Ποιότητα ζωής
Ο συνδυασμός ERLEADA® + ADT καθυστερεί την εξέλιξη της νόσου και διατηρεί τη σχετιζόμενη με την υγεία ποιότητα ζωής των ασθενών (HRQoL)*
Οι άνδρες που έχουν διαγνωσθεί με υψηλού κινδύνου nmCRPC έχουν παρόμοια HRQoL με τον γενικό πληθυσμό, επομένως είναι ζωτικής σημασίας τα επίπεδα αυτά να διατηρηθούν για όσο το δυνατόν μεγαλύτερο διάστημα
Στη διάρκεια της μελέτης SPARTAN, οι βαθμολογίες για πέντε υποκλίμακες του FACT-P αξιολογήθηκαν και αθροίστηκαν σε μια ενιαία συνολική βαθμολογία:
- Φυσική ευεξία (επτά στοιχεία)
- Κοινωνική και οικογενειακή ευεξία (επτά στοιχεία)
- Συναισθηματική ευεξία (έξι στοιχεία)
- Λειτουργική ευεξία (επτά στοιχεία)
- Υποκλίμακα καρκίνου του προστάτη (12 στοιχεία)
ΣΥΝΟΛ�ΙΚΗ ΒΑΘΜΟΛΟΓΙΑ ΣΤΟ FACT-P16
Η συνολική βαθμολογία του FACT-P κυμαίνεται από 0 έως 156, όπου οι υψηλότερες τιμές υποδηλώνουν καλύτερη HRQoL
ΕΜΠΕΙΡΙΑ ΑΝΕΚΤΙΚΟΤΗΤΑΣ16
Πόσο ενοχλήθηκαν οι ασθενείς από τις παρενέργειες της θεραπείας τους
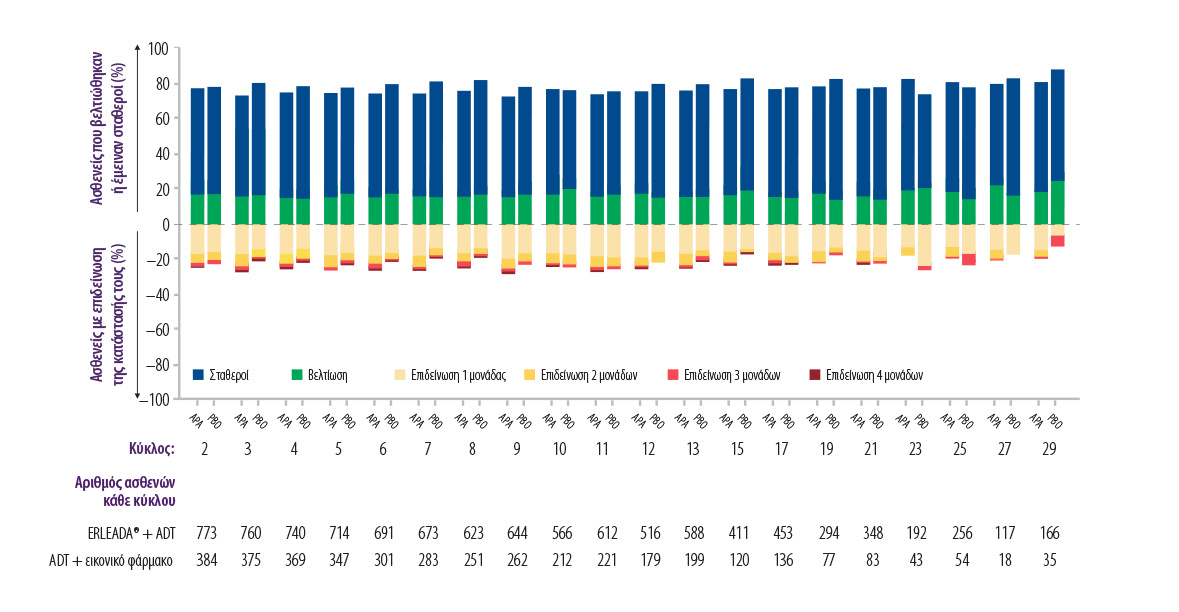
APA= ERLEADA® + ADT, PBO= ADT + εικονικό φάρμακο
• Οι περισσότεροι ασθενείς σε αμφότερες τις ομάδες θεραπείας ανέφεραν ότι δεν ενοχλήθηκαν «καθόλου» από παρενέργειες της θεραπείας
• Η ανεκτικότητα της θεραπείας ήταν παρόμοια ανάμεσα στα θεραπευτικά σκέλη
*H HRQoL αξιολογήθηκε βάσει των αλλαγών στις βαθμολογίες του FACT-P και του EQ-5D-3L από την έναρξη έως τους 29 μήνες.
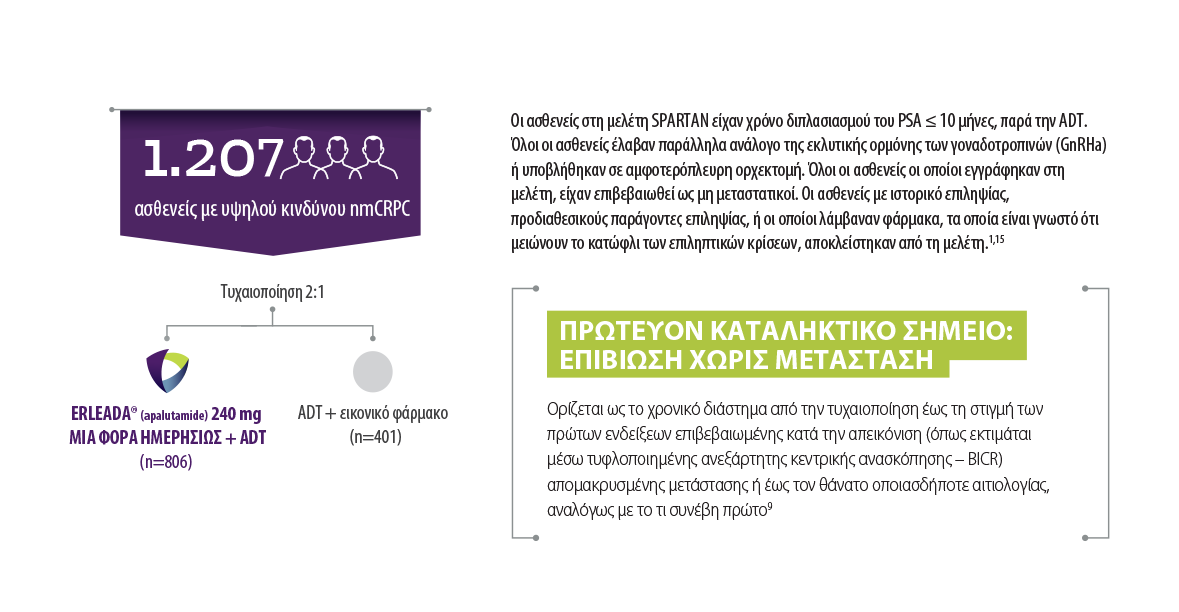
Μελέτη SPARTAN
Ο συνδυασμός ERLEADA® + ADT έχει δοκιμαστεί στη φάσης ΙΙΙ μελέτη SPARTAN, στην οποία συμμετείχαν περισσότεροι από 1.200 ασθενείς με υψηλού κινδύνου nmCRPC παγκοσμίως
Χορήγηση
Βολική, μία φορά ημερησίως κατ’ οίκον χορήγηση από το στόμα με το ERLEADA®
Η συνιστώμενη δόση του ERLEADA® είναι 240 mg (4 δισκία των 60 mg) χορηγούμενα από στόματος μία φορά ημερησίως*

• Μπορούν να ληφθούν με ή χωρίς τροφή
• Χωρίς επιπλέον απαιτήσεις εργαστηριακής παρακολούθησης πέρα από τις συνήθεις αξιολογήσεις παρενεργειών
*H ADT θα πρέπει να συνεχίζεται κατά τη διάρκεια της θεραπείας με ERLEADA® σε ασθενείς, οι οποίοι δεν έχουν υποβληθεί σε χειρουργικό ευνουχισμό.
ERLEADA® ΠΧΠ
.png?width=360&height=123&format=png&quality=50)